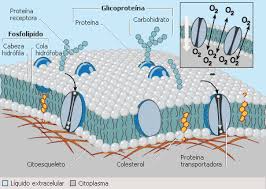
a. Uniones Celulares
La adhesión célula – célula es un proceso selectivo, de tal forma que las células se adhieren solamente a otros tipos específicos de células. Esta adhesión viene mediada por proteínas transmembrana denominadas moléculas de adhesión celular, que pueden dividirse en 4 grupos principales: selectinas, integrinas, súper familias de las inmunoglobulinas Ig y las cadherinas. La adhesión celular mediada por selectinas, integrinas cadherinas requiere Ca2+ o Mg2+.
i. Desmosomas
Los desmosomas son un tipo de unión celular que mantiene unidas a las células. Desmosomas y hemidesmosomas son las principales uniones celulares, son sitios de fijación de superficie para los filamentos intermedios célula-célula y contacto de célula-sustrato. Las moléculas transmembrana del desmosoma pertenecen a la familia de las caderinas las cuales son moléculas de adhesión dependiente de calcio, mientras que en el hemidesmosoma incluyen la clase de integrinas de la matriz receptores de las células. En cada cruce, los dominios citoplasmáticos de determinados componentes de unión transmembrana contienen terminales largas colas carboxil-excepcionalmente y no se encuentran en los miembros de la familia que participan en la vinculación de actina a la superficie celular. Estos dominios se cree que son importantes para la regulación del conjunto de conexiones y son específicos de unión de los filamentos intermedios a través de proteínas asociadas adaptadoras. Los acontecimientos recientes han sugerido la posibilidad de que estas uniones, además de jugar una función estructural importante en la integridad de los tejidos, son aceptores y affectores de vías de señalización celular. Muchos componentes desmosomales y hemidesmosomales son fosfoproteínas y en ciertos casos la función de los sitios específicos de fosforilación en la regulación de las interacciones proteína-proteína es sin cobertura. Además, un papel más activo en la transmisión de señales que el control de la morfogénesis durante el desarrollo y posiblemente, incluso regular el crecimiento y diferenciación celular están siendo definidas y componentes de la membrana citoplasmática de estas uniones.
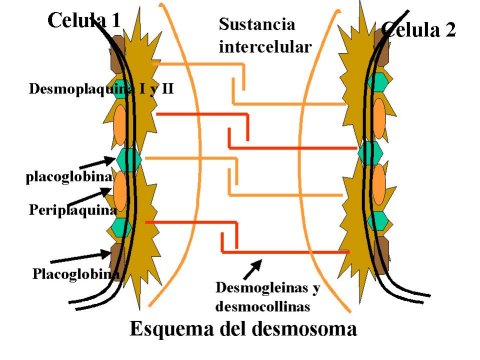
Green et al; 1996. Desmosomes and hemidesmosomes: structure and function of molecular components. The FASEB Journal, Vol. 10, 871-881.
ii. Uniones estrechas
La polaridad de proteínas celulares está regulada por la ocludina, la cual se ha visto es una proteína de unión estrecha de las más conocidas y más estudiadas en la actualidad y donde se ha visto con mayor relevancia su funcionalidad es en células epiteliales. Además se le ha visto involucrada en la migración celular.
Las uniones estrechas, o occludens zonula, son las áreas asociadas de cerca de dos células cuya membrana se unen formando una barrera prácticamente impermeable a los líquidos. Es un tipo de complejo de unión presente sólo en los vertebrados . Las uniones correspondientes que se producen en los invertebrados son uniones septadas. Los principales tipos de proteínas asociadas a estas uniones son las claudinas y ocludinas.
Sus funciones son:
Llevan a cabo las células juntas.
Ayudan a mantener la polaridad de las células al impedir la difusión lateral de las proteínas integrales de membrana entre la apical y lateral / basal superficies, permitiendo que las funciones especializadas de cada superficie (por ejemplo, mediada por receptores de endocitosis en la superficie apical y exocitosis en la superficie basolateral) que se conserva. Este tiene como objetivo preservar el transporte transcelular.
Impiden el paso de moléculas e iones a través del espacio entre las células. Así materias realmente debe entrar en las células (por difusión o transporte activo ) para pasar a través del tejido. Esta vía permite controlar qué sustancias se permiten a través. (Uniones estrechas desempeñan este papel en el mantenimiento de la barrera sangre-cerebro ). En la actualidad, todavía no está claro si el control está activo o pasivo y cómo se forman estas vías.
En un estudio para el transporte paracelular a través de la unión estrecha en el túbulo proximal del riñón, un modelo de doble vía se propone: se rompe tamaño que se forma por las discontinuidades poco frecuente en el complejo de TJ y numerosas circulares pequeños poros.
Du et al; 2010. The Tight Junction Protein, Occludin, Regulates the Directional Migration of Epithelial Cells. Developmental Cell, Volume 18, Issue 1, 52-63, 19 DDD
i. Uniones Comunicantes
Las uniones de tipo gap constituyen el tipo de uniones quizás más intrigantes . muestran una amplia distribución siendo muy numerosas en la mayoría de los tejidos de la práctica total de las especies animales, median la comunicación intercelular al permitir el paso de iones inorgánicos y otras pequeñas moléculas hidrosolubles entre los respectivos citoplasmas, acoplando las células tanto eléctrica como metabólicamente. Este acoplamiento celular tiene importantes implicaciones funcionales.
Unión comunicante (inglés: gap junction): Unión que forma un poro por el cual logran pasar moléculas del citoplasma de una célula al citoplasma de otra sin pasar por el espacio extracelular. La componen conexinas que se unen para formar un conexón que son compuestos de 6 subunidades. Un tipo particular de unión entre células animales lo constituye la unión comunicante (gap junction), en este caso las membranas de ambas poseen proteínas que conforman semicanales de transmembrana, que las interconectan y permiten el paso de moléculas entre ambas.
La evidencia de que las uniones de tipo gap median el acoplamiento eléctrico y químico entre las células que se hallan en contacto puede constatarse a partir de diversas fuentes.
Cabe mencionar que la mayor parte de las células embrionarias están acopladas entre si durante las primeras etapas del desarrollo por las uniones de tipo gap.
Alberts et al; 2002. Biología molecular de la célula. Uniones celulares y matriz extracelular. Omega. 641.
a. Matriz extracelular
i. Matriz extracelular de tejidos animales
Los tejidos no están formados únicamente por células. Una buena parte de su volumen lo constituye el espacio extracelular, el cual está ocupado por una intrincada red macromolecular que constituye la matriz extracelular. La matríz está compuesta por polisacáridos y proteínas muy diversas secretadas localmente y ensamblados en una red compleja en íntima asociación con la superficie celular.
Las macromoléculas que constituyen la matriz extracelular son de cuatro grandes tipos:
(1) sistema colágeno
(2) sistema elástico
(3) proteoglicanos
(4)glicoproteínas multifuncionales (laminina, fibronectina, tenascina, trombospondina y otras).
Cada una desempeña funciones de manera integrada con las demás; esto hace que la matriz sea calificada como un verdadero complejo funcional. Los colágenos y el sistema elástico constituyen la arquitectura de la matriz extracelular. Las glicoproteínas actúan como moléculas de adhesión del sustrato intercelular, importantes en las interacciones célula-célula y célula-matriz. Los glicosaminoglicanos y proteoglicanos tienen un papel fundamental en el equilibrio hidroelectrolítico y ácido básico
i. Biosíntesis de colágena
La colágena es la proteína más abundante de la matriz extracelular. Los colágenos forman una gran familia de proteínas que tienen por características agruparse formando una estructura supramolecular. De modo general, las moléculas resultan de la asociación de tres cadenas polipeptídicas en con una formación característica de triple hélice. Además de la triple hélice, los colágenos poseen dominios globulares, que le confieren flexibilidad y especificidad a las moléculas que los poseen.
Actualmente se conocen aproximadamente 27 tipos de colágenos con diferentes localizaciones y desempeñan diferentes funciones. Los colágenos han sido clasificados teniendo en cuenta la forma en que se agregan: colágenos fibrilares I, II, III, V y XI y colágenos no fibrilares VI, VII, VIII, X.
Cada una de las cadenas polipeptídicas de colágena es sintetizada por los ribosomas unidos a membrana e incorporada a la luz del retículo como grandes precursores, denominados procadenas alfa. Estos precursores no solo poseen en la región amino terminal el péptido señal necesario para transportar el polipéptido naciente a través de la membrana del retículo , sino que también presentan otros aminoácidos suplementarios , denominados propéptidos, situados en las regiones amino y carboxilo terminales. Cada procadena alfa se combina con otras dos mediante enlaces de hidrógeno, formando secretadas de colágena fibrilares, son convertidas en el espacio extracelular en moléculas de colágena mediante la liberación de los propéptidos. Después de su secreción, las moléculas fibrilares de procolágena son degradadas hasta moléculas de colágena las cuales se organizan en fibrillas. el colágeno está presente en diferentes tipos de tejido como se muestra en la tabla 1.
 Mejías y Cañadas. 2008. Fisioterapia. Respuesta fisiológica del tejido conjuntivo de músculos y tendones tras la aplicación de los agentes físicos. 30:6
Mejías y Cañadas. 2008. Fisioterapia. Respuesta fisiológica del tejido conjuntivo de músculos y tendones tras la aplicación de los agentes físicos. 30:6
SINTESIS DE COLÁGENA
i. Glucosaminglicanos y proteoglicanos
Los proteoglicanos son complejos de macromoléculas formados por la asociación covalente entre cadenas polipeptídicas y glicosaminoglicanos. Estas últimas se forman de polímeros de unidades de disacáridos repetidas (hexosamina más ácido hexaúronico y en gran parte presentan diferentes niveles de sulfatación, como el condroitin-sulfato, dermatan-sulfato, queratan-sulfato y heparan-sulfato. El núcleo proteico de los diferentes proteoglicanos varía de peso molecular, de 19 a 500 Kd. El número de cadenas de glicosaminoglicanos varía de 1 a 100; la estructura primaria está formada por un proteoglicano pequeño: serina-glicina, que presenta un núcleo proteico y 14 cadenas de glicosaminoglicanos. El ácido hialurónico es el único glucosaminoglicano que no se une a la cadena peptídica; tiene un papel muy importante en la migración celular. Facilita la hidratación de los tejidos, debido a la gran cantidad de radicales libres, que se ligan a las moléculas de agua. Por lo tanto, la hidratación de los tejidos depende de la concentración y el estado fisiológico del ácido hialurónico. Estudios recientes han demostrado que el ácido hialurónico al unirse a la proteína B forma el complejo ácido hialurónico proteína B. Este complejo ha sido asociado al estímulo de la actividad de proteína quinasa, que sirve como señal de traducción a nivel celular, y tiene un papel importante en la interacción de la superficie celular con el citoesqueleto. La función de los proteoglicanos es contribuir a la adhesividad celular mediante
su interacción con la superficie celular y con otros componentes matriciales. El sindecan, por ejemplo, proteoglicano de la membrana celular, transmite señales a proteínas transmembranales, como las integrinas, que a su vez interactúan con el citoesqueleto, el cual facilita la interacción de los filamentos de actina. La unión sindecan a la fibronectina es mediada por el heparan-sulfato. Los proteoglicanos pueden regular la diferenciación y proliferación celular en algunos tejidos, incluidos el cartílago, donde se observó aumento en la adhesión celular a medida que el condroblasto se diferencia en condorcito. Además de la interacción con fibronectina, el heparan-sulfato de los fibroblastos y de las células epiteliales sirve como mediador de interacción con colágenos, siendo esta unión más fuerte con el colágeno V. El heparan-sulfato perlecan es el primero de los proteoglicanos en aparecer en la lámina basal junto con la laminina y el colágeno IV estableciendo las bases estructurales de las membranas basales como se observa en las membranas basales trofoblástica, los vasos coriales y en la lámina basal de los epitelios en general.
i. Otras proteínas estructurales de matriz extracelular
Fibronectina: El papel de las fibronectina consiste en unir las células a una variedad de matrices extracelulares. La fibronectina une las células a todas las matrices excepto la del tipo IV que involucra a la laminina como la molécula de adhesión. Las fibronectinas son dímeros de 2 péptidos similares. Cada cadena mide 60–70nm de longitud y 2-3nm de grosor. Al menos 20 diferentes cadenas de fibronectina han sido identificadas que surgen del procesamiento alternativo "splicing" del RNA de la copia primaria de un sólo gen de la fibronectina. Las fibronectinas contienen por lo menos 6 dominios doblados estrechamente cada uno con una alta afinidad por un diferente sustrato, como por ejemplo, heparan sulfato, colágeno (dominios separados para los tipo I, II y III), fibrina y receptores de superficie. El dominio de unión de receptores en la superficie celular contiene siempre la misma secuencia de amino ácidos.
Laminina: Todas las láminas basales contienen un mismo grupo de proteínas determinadas y GAGs (glucosaminglicanos). Estas son el colágeno tipo IV, proteoglicanos de heparan sulfato, entactina y laminina. A la lámina basal se la llama frecuentemente matriz tipo IV. Todos los componentes de la lámina basal son sintetizados por las células que yacen sobre ésta. La laminina une las superficies celulares a la lámina basal.
Elastina: confiere a los tejidos su elasticidad, permite mediante la matriz extracelular que los tejidos recobren su conformación original después de una deformación transitoria. Por lo tanto es el componente principal de las fibras elásticas.
Integrinas: Naturalmente, el enlace entre la integrina y fibronectina debe mantener una fuerza significativa para transmitir señales de vigor. Se ha sabido durante mucho tiempo que los cationes bivalentes integrinas reclutar a los efectos vinculantes ligando.
Las integrinas son una familia de glicoproteínas que participan mayormente en la unión de las células con la matriz extracelular, aunque hay algunas que también participan en la unión célula-célula. Están presentes en la superficie celular en elevadas concentraciones. Fundamentalmente son receptores de membrana, algunos reconocen fibronectina, laminina, que son componentes mayoritarios de la matriz extracelular. Algunas de estas integrinas pueden ser específicas para una sola molécula, pero en cambio hay otras que pueden reconocer diferentes ligandos. Las integrinas asocian a la matriz extracelular con el citoesqueleto de la célula. El tipo de ligando que se unirá a una u otra integrina vendrá dado por el tipo de subunidades α y β que posea la integrina. Entre los múltiple ligandos de las integrinas se encuentran la fibronectina, la vitronectina, el colágeno y la laminina. La conexión entre la célula y la matriz extracelular podría ayudar a que la célula soporte fuerzas de empuje sin ser arrancada de la matriz. La capacidad de la célula para crear este tipo de unión es de vital importancia en la ontogenia.

Du et al; 2010. The Tight Junction Protein, Occludin, Regulates the Directional Migration of Epithelial Cells. Developmental Cell, Volume 18, Issue 1, 52-63, 19 DDD
Mejías y Cañadas. 2008. Fisioterapia. Respuesta fisiológica del tejido conjuntivo de músculos y tendones tras la aplicación de los agentes físicos. 30:6
Alberts et al; 2002. Biología molecular de la célula. Uniones celulares y matriz extracelular. Omega. 641.
http://www.cellbiol.net/docs/Integrins.pdf Green et al; 1996. Desmosomes and hemidesmosomes: structure and function of molecular components. The FASEB Journal, Vol. 10, 871-881. Arenas y Zurbaran. 2002. La matriz extracelular: El ecosistema de la célula. Salud Uninorte. Barranquilla (Col.), 16: 9-18